Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43 (третья ступень).
Ступенчатой
диссоциацией
многоосновных
кислот
объясняется
образование
кислых солей.
Номенклатура кислот.
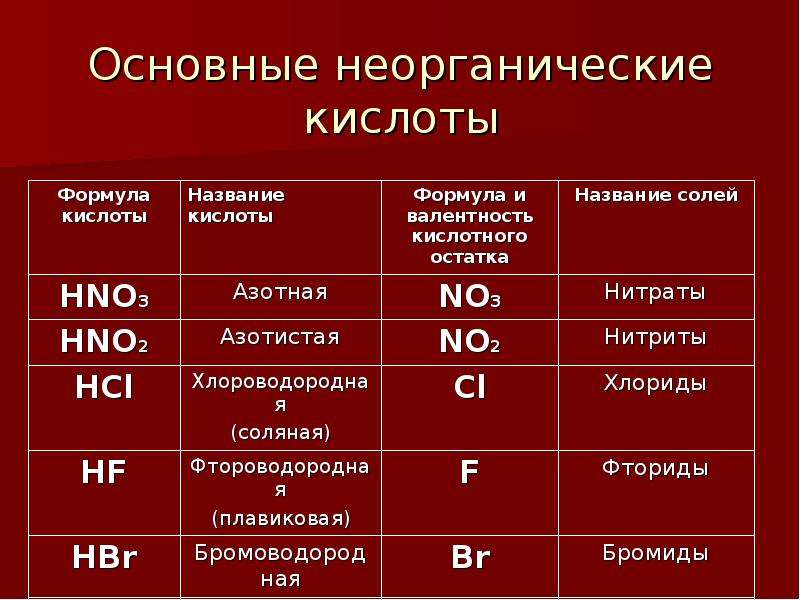
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс ист:
H2SO3 сернист
ая кислота,H3AsO3 мышьяковистая кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO
хлорноватистая
кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O →
2H3O
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная название кислоты, записываем сначала водород, а затем кислотообразующий элемент. Степень окисления водорода в кислотах всегда +1. Степень окисления элемента отрицательная. Она равна номеру группы ПСЭ (в которой находится элемент) минус восемь.
Например:
сероводородная
кислота
элемент сера,
расположен в
шестой
группе ПСЭ. 6 — 8 = -2.
Степень
окисления серы
2. Записываем
символы
водорода и
серы Н+S-2, т. к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например: метафосфорная кислота кислотообразующий элемент фосфор. Суффикс н показывает, что он имеет максимальную степень окисления, фосфор в пятой группе ПСЭ, следовательно, максимальная степень окисления +5, она сохраняется и в оксиде фосфора Р2+5О5-2. Приставка мета говорит о том, что воды в кислоте минимальное количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O →
H6P2O8 →
2H3PO4
ортофосфорная
кислота.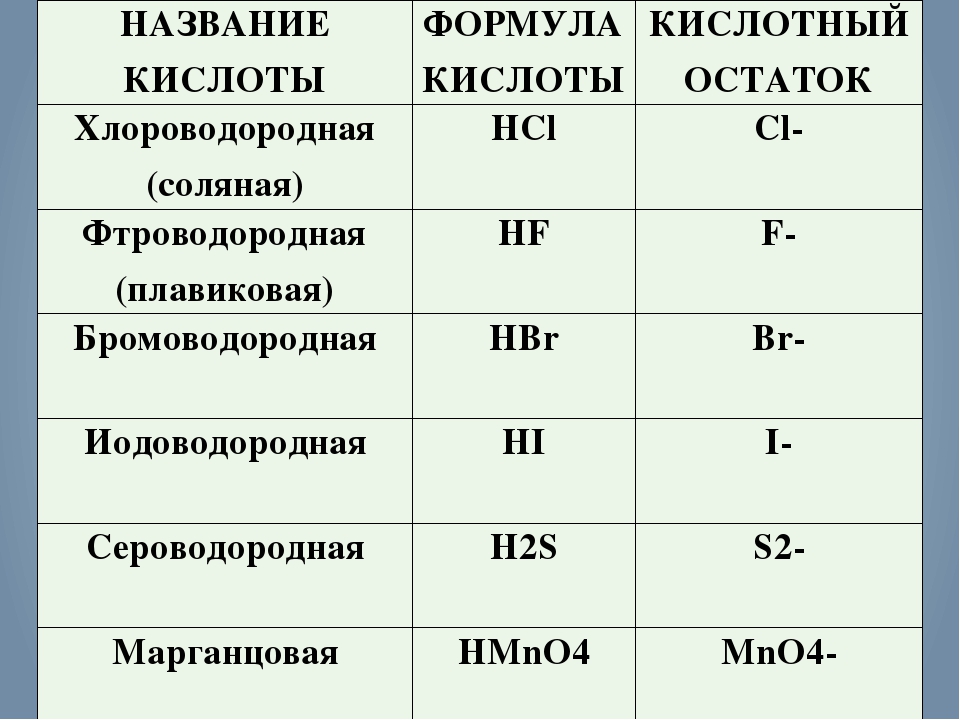
Классификация кислот по следующим признакам:
По содержанию кислорода:
1. Кислородосодержащие 2. Бескислородные
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO 3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %)
2. Слабые (α < 100 %)
Сильные (α =100 %)
2. Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение
соответствующего
оксида в воде:
Растворение
соответствующего
оксида в воде:
P2O5 + 3H2O → 2H3PO4.
3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие
с солями:
Взаимодействие
с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
H2SO4 + NaCI → NaHSO4 + HCI
конц. тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.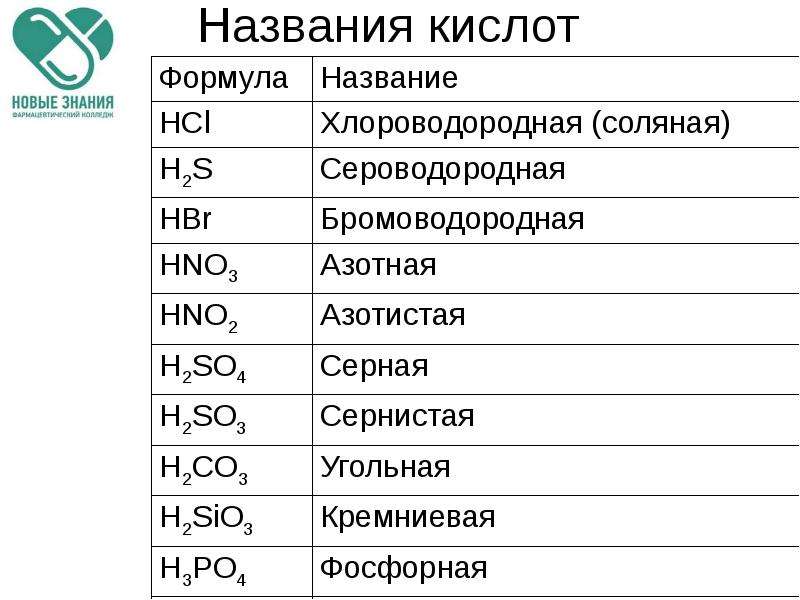
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1. Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3 и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в
фарфоровую
чашку 10 см3 2
моль/дм3 раствора гидроксида
натрия.
Добавить 12
капли
фенолфталеина,
чтобы
окраска
стала
малиновой,
что подтверждает
наличие
щелочи в
растворе. Затем
в пробирку по
каплям
добавлять
раствор
соляной
кислоты, до
обесцвечивания
раствора.
Выпарить
содержимое
чашки и
убедиться,
что
образовалась
соль.
Написать
уравнение реакции.
Кислоты бескислородные — Справочник химика 21
Кислоты — соединения, которые при электролитической диссоциации в качестве катионов образуют только ионы водорода. По химическому составу различают кислоты бескислородные и кислородсодержащие. [c.26]Получение кислот. Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом [c.238]
Кислоты можно получать растворением ангидридов в воде. Если ангидриды в воде нерастворимы, то кислоту получают действием на ее соль другой кислотой, как правило, более сильной. Последний способ характерен н для кислородных, и для бескислородных кислот. Бескислородные кислоты получают также прямым синтезом из водорода и неметалла с последующим раствор ением полученного соединения в воде [c.31]
В последней реакции сернистая кислота, которая была упомянута в качестве восстановителя, проявляет свое окислительное действие за счет серы в степени окисления (4+), а сероводород — свое восстановительное действие за счет серы в степени окисления (2 ).
 Своеобразной окислительной реакцией является электролиз растворов кислот. Бескислородные кислоты при этом окисляются (кроме фтористоводородной кислоты) с образованием неметаллов [c.244]
Своеобразной окислительной реакцией является электролиз растворов кислот. Бескислородные кислоты при этом окисляются (кроме фтористоводородной кислоты) с образованием неметаллов [c.244]Отношение воды к неметаллам. С активными неметаллами (хлором, бромом, иодом) вода образует две кислоты — бескислородную и кислородную [c.128]
При гидролизе водой хлорангидриды образуют две кислоты — бескислородную и кислородную. Например [c.241]
Кислота борная Смесь кислот Меланж кислотный Кислоты бескислородные Кислота соляная / (хлористоводородная) [c.50]
При введении алкила в кислотный гидроксил, т. е. при замене кислотного атома водорода спиртовым радикалом, получаются сложные эфиры кислот (бескислородных и кислородных) [c.184]
Конденсация 5,6-диметокси-4-цианометил-1,2-нафтохинона (IX) с бутадиеном приводит к 3,4-диметокси-9,10-диоксо-13-цианометил-5, 8, 9, 10, 13,14-гексагидрофенантрену (X). При восстановлении дикетона (X) над медно-хром-окисным катализатором получен кетолактам (XII), теряющий кислород при восстановлении литийалюминийгидридом и дающий после метилирования (смесью формальдегида и муравьиной кислоты) бескислородное основание (XI) [c.465]
При восстановлении дикетона (X) над медно-хром-окисным катализатором получен кетолактам (XII), теряющий кислород при восстановлении литийалюминийгидридом и дающий после метилирования (смесью формальдегида и муравьиной кислоты) бескислородное основание (XI) [c.465]
Закон постоянства состава и постоянства свойств веществ (законы Пруста). Свойства простых веществ и соединений, принятые для установления их индивидуальности химический состав, физические свойства (удельный вес, температура плавления и кипения, растворимость, цвет, запах, форма кристаллов и пр.), химические свойства. Понятие о классификации неорганических веществ по химическим свойствал4 окислы, гидраты окислов (основания, кислоты), бескислородные кислоты, гидриды, соли средние, кислые и основные. Названия солей. Структурные формулы соединений различных классов. Приемы очистки веществ перегонка, возгонка, экстрагирование, перекристаллизация. Понятие о квалификации, определяющей чистоту вещества чистое, ч. д. а. (чистое для анализа), х. ч. (химически чистое) вещество. Правила пользования сухими реактивами и их растворами, значение этикеток, тара и укупорка, условия хранения реактивов. [c.34]
д. а. (чистое для анализа), х. ч. (химически чистое) вещество. Правила пользования сухими реактивами и их растворами, значение этикеток, тара и укупорка, условия хранения реактивов. [c.34]
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Свойства кислот
Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Общая формула кислот НnА, где А — кислотный остаток. Кислоты (с точки зрения электролитической диссоциации) представляют собой электролиты, диссоциирующие в водных растворах на катионы водорода Н+ и анионы кислотного остатка.
Классификация. По наличию
(отсутствию) кислорода в составе кислот они подразделяются на
кислородсодержащие (например,
H3PO4и
H2SO4) и
бескислородные (например,
HCl и
HBr). По основности (числу ионов
H+, образующихся при полной
диссоциации, или количеству ступеней диссоциации) кислоты делятся на
одноосновные (если образуется один ион
H+: HClH+ + Cl–; одна
ступень диссоциации) и многоосновные
– двухосновные (если образуются
два иона H+:
H2SO4 2H+
+ SO42–; две ступени диссоциации),
трехосновные (если образуются три иона
H+: H3PO4 3H+
+ PO43–; три ступени диссоциации) и т. д.
д.
Физические свойства. Кислоты бывают газообразные, жидкие и твердые. Некоторые имеют запах и цвет. Кислоты отличаются различной растворимостью в воде.
Химические свойства кислот
1) Диссоциация: HCl + nH2OH+×kH2O + Cl–×mH2O (сокращенно: HClH+ + Cl– ).
Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4 H+ + НSO4– (1 ступень) и HSO4– H+ + SO42– (2 ступень).
2) Взаимодействие с индикаторами:
индикатор + Н+ (кислота) окрашенное
соединение.
Фиолетовый лакмус и оранжевый метилоранж окрашиваются в кислых средах в розовый цвет, бесцветный раствор фенолфталеина не меняет своей окраски.
3) Разложение. При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 SiO2 + H2O.
Бескислородные кислоты распадаются на простые вещества:
2HCl Cl2 + H2.
Кислоты-окислители разлагаются сложнее:
4НNO3
4NO2
+ 2H2O + O2.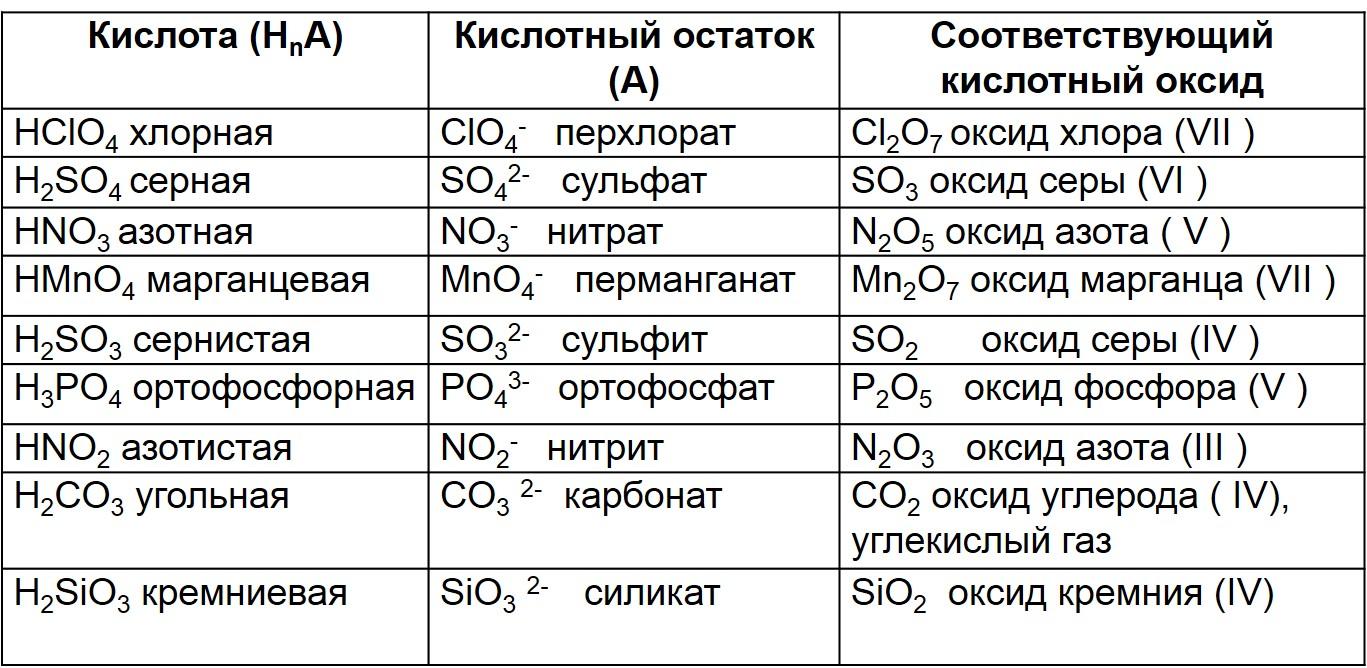
4) Взаимодействие с основаниями и амфотерными гидроксидами:
H2SO4+ Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42–+ Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4+ Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
5) Взаимодействие с основными и амфотерными оксидами:
H2SO4+ CaO ® CaSO4¯ + H2O 2H+ + SO42–+ CaO ® CaSO4¯ + H2O
H2SO4+
ZnO
®
ZnSO4 + H2O 2H+ +
ZnO
®
Zn2+ + H2O.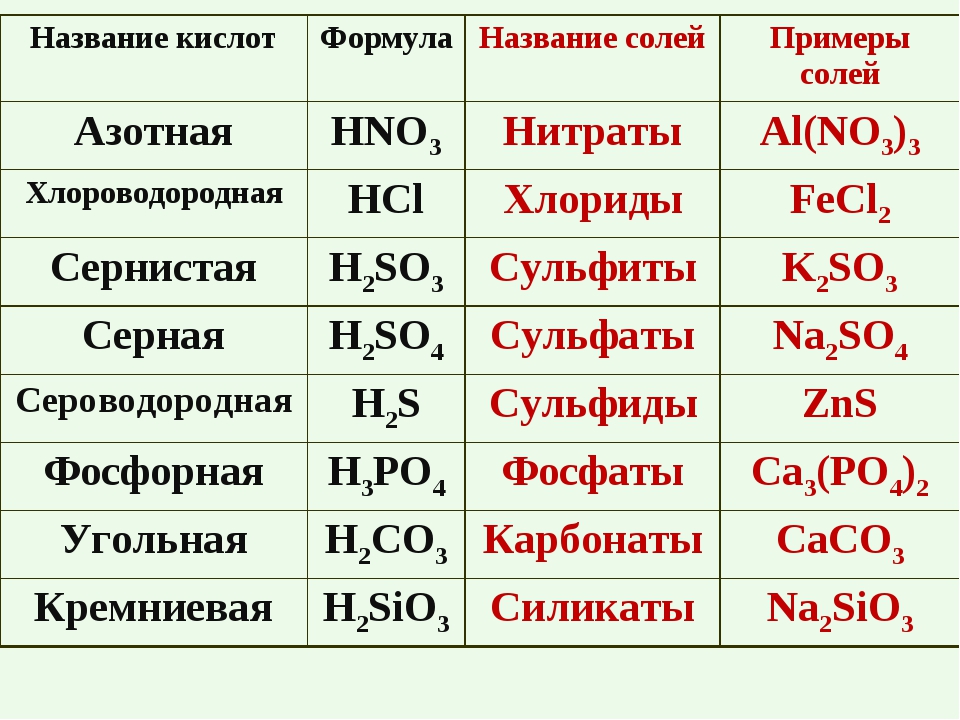
6) Взаимодействие с металлами: а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, H2SO4, H3PO4и др.).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
2HCl + Fe ® FeCl2 + H2 2H+ + Fe ® Fe2+ + H2.
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.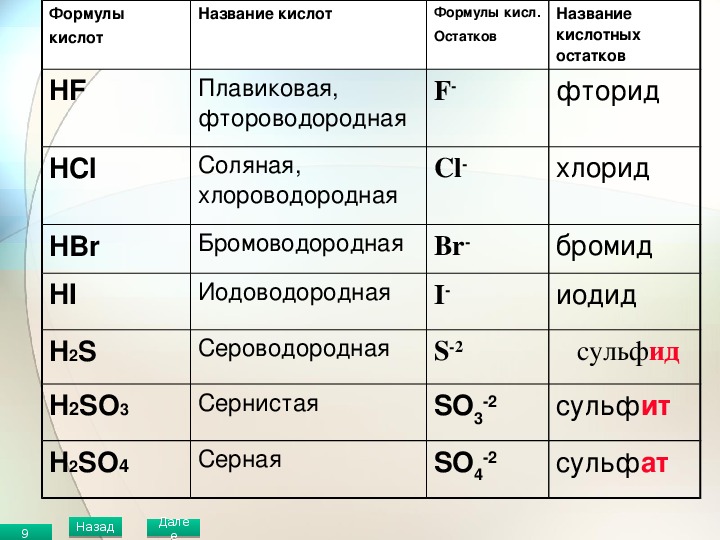 ) Fe2(SO4)3
+ 3SO2
+ 6H2O
) Fe2(SO4)3
+ 3SO2
+ 6H2O
2Fe + 12H++ 3SO42–® 2Fe3+ + 3SO2 + 6H2O.
7) Взаимодействие с солями. Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3® 2NaCl + CO2 + H2O 2H+ + CO32–® CO2 + H2O
СaCl2 + H2SO4
® CaSO4¯
+ 2HCl
Сa2+
+ SO42-
® CaSO4¯.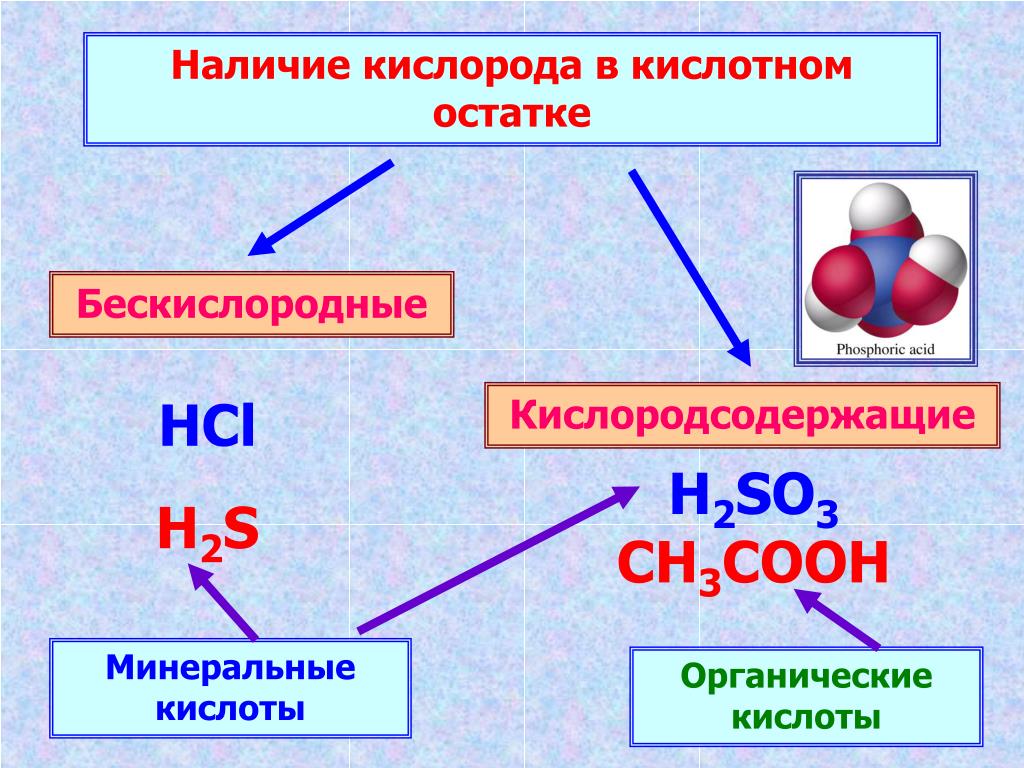
Получение. Бескислородные кислоты получают:
1) Из неметаллов и водорода с последующим растворением образовавшегося газа в воде:
Cl2 + H2 2HCl.
2) При действии сильных кислот на соли более слабых или летучих бескислородных кислот:
2HCl + Na2S ® 2NaCl + Н2S 2H+ + S2– ® Н2S.
Кислородсодержащие кислоты получают:
1) Взаимодействием
кислотного оксида и воды. Оксид кремния(IV)
SiO2с водой не реагирует!
Оксид кремния(IV)
SiO2с водой не реагирует!
SO2 + H2O H2SO3.
2) При действии сильных кислот на соли более слабых или летучих кислородсодержащих кислот:
2HCl + Na2CO3® 2NaCl + Н2СО3 2H+ + CO32– ® Н2СО3.
Л.А. Яковишин
Химия
КИСЛОТЫ
Оглавление:
1. Определение
2. Классификация
3. Электролитическая
диссоциация
4. Получение
Получение
5. Важнейшие химические
свойства
6. Специфические свойства
7. Задания
8. Ответы
|
Кислоты – это сложные вещества, состоящие из катионов водорода и анионов кислотных остатков. |
КЛАССИФИКАЦИЯ
1. По числу атомов водорода, способных замещаться на атомы металлов кислоты разделяют на одноосновные, двухосновные и трёхосновные.
2. По наличию или отсутствию атомов кислорода в молекуле различают бескислородные и кислородсодержащие кислоты.
Существуют и другие способы классификации кислот.
По силе (по степени диссоциации)
1. Сильные
(α
=100 %)
2.
Слабые
(α
< 100 %)
Сильные
(α
=100 %)
2.
Слабые
(α
< 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
HCl, HNO3 H2SiO3, H2MoO4
По стабильности
1. Стабильные 2. Нестабильные
HCl, HF, H2SO4 , HNO3, H2SO3, H2SiO3, H2CO3
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Растворимые кислоты при растворении в воде
диссоциируют на катионы водорода и анионы кислотных остатков.
HCl →
H+ + Cl—
Диссоциация многоосновных кислот протекает ступенчато.
H2SO4 → H+
+ HSO4—
HSO4—↔ H+ + SO42—
ВАЖНЕЙШИЕ СПОСОБЫ ПОЛУЧЕНИЯ
1. Галоген + водород = галогеноводород
(растворением галогеноводорода в воде получают соответственную
галогеноводородную кислоту.)
H2 +Cl2 = 2HCl
2. Кислотный оксид + вода = кислота
SO3 + H2O = H2SO4
3. Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 + H2SO4
= BaSO4 + 2HCl
ВАЖНЕЙШИЕ ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакция нейтрализации: кислота + основание =
соль + вода
Реакция нейтрализации: кислота + основание =
соль + вода
H2SO4
+ 2NaOH = Na2SO4
+ 2H2O
При неполной нейтрализации многоосновной кислоты основанием
получают кислую соль:
H2SO4
+ NaOH = NaHSO4
+ H2O
При неполной нейтрализации многокислотного основания кислотой
получают основную соль:
Zn(OH)2
+ HCl = ZnOHCl +
H2O
2. Кислота + металл = соль + водород
(кислоты кроме
HNO3 иH2SO4(конц.);
металлы кроме стоящих в электрохимическом ряду напряжений металлов
правее водорода)
Zn + 2HCl
= ZnCl2 + H2↑
3. Кислота + основный (амфотерный) оксид = соль
+ вода
3H2SO4+Al2O3=Al2(SO4)3+
3H2O
4. Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
Кислота + соль = другая кислота + другая соль
(для этой реакции используют более сильную кислоту)
AgNO3 + HCl = AgCl + HNO3
BaCl2 +
H2SO4
= BaSO4 + 2HCl
5. Кислоты (благодаря диссоциации на ионы) изменяют
окраску индикаторов:
Лакмус: синий → розовый;
Метилоранж оранжевый → красный
СПЕЦИФИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1. Реакции азотной кислоты и концентрированной серной кислоты с металлами.
При реакциях металлов с азотной кислотой различных
концентраций и с концентрированной серной кислотой не выделяется
водород. Вместо водорода ( в зависимости от кислоты) образуются
различные соединения серы или азота и вода. Схемы этих химических
реакций можно записать следующим образом:
Me + HNO3 = MeNO3 + X + H2O,
где X= NH4NO3; N2; N2O
; NO ; NO2;
Me +
H2SO4(конц. )
= MeSO4 + X + H2O,
где X= H2S ; S
; SO2
)
= MeSO4 + X + H2O,
где X= H2S ; S
; SO2
Образующиеся продукты «Х» зависят от концентрации кислоты и
активности металла. См. таблицу:
| Кислота/ Металл |
Li; Na; K; Mg; Ca;Ba |
Аl*; Zn; Fe*; Ni;
Ti;
Cr; Sn;
Pb
|
Cu; Ag ; Hg |
Au; Pt; Ta |
| HNO3 (конц.) |
N2O |
NO2 |
NO2 |
Не реагируют |
HNO3(разб. ) )
|
Nh4 ( NH4NO3 ) |
NO; NO2 ;N2 ; NH3(
NH4NO3 ) |
NO |
Не реагируют |
| H2SO4 (конц.) |
S , H2S, SO2 |
S , H2S, SO2 |
SO2 |
Не реагируют |
Fe*, Аl*
с концентрированной азотной кислотой и холодной концентрированной серной
кислотой не реагируют, поэтому данные кислоты можно перевозить в
алюминиевых и стальных цистернах. .
.
Например:
а) с азотной кислотой
10 HNO3(конц.) + 8Na = 8Na NO3 + N2O +
5H2O
4 H NO3(конц.) + Zn = Zn(NO3)2 + 2NO2
+ 2H2O
4 H NO3(конц.) + Cu =
Cu(NO3)2 + 2NO2
+ 2H2O
8 HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO +
4H2O
36 H NO3(разб.) + 10Fe = 10Fe(NO3)3 +
3N2 + 18H2O
9 HNO3(разб.) + 8Na = 8Na NO3 + NH3 +
3H2O
б) с концентрированной серной кислотой
Zn + 2H2SO4(конц.)
= ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(конц.)
= 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(конц. )
= 3ZnSO4 + S + 4H2O
)
= 3ZnSO4 + S + 4H2O
Сu +
2H2SO4(конц.)
= Сu SO4
+ SO2 + 2H2O
в) смесь, состоящая из одной части
концентрированной азотной кислоты и трёх частей концентрированной
азотной кислоты растворяет золото. Такая смесь называется царской
водкой.
Au + HNO3 + 4HCl
= H[AuCl4] + NO + 2H2O
2. Азотная кислота и концентрированная серная кислота как сильные окислители могут реагировать с неметаллами.
3P + 5HNO3 + 2H2O
=
3H3PO4 + 5NO
S + 2НNO3
=
H2SO4 +
2NO
C + 2H2SO4(конц.)
=
CO2 + 2SO2 + 2H2O
S + 2Н2SO4(конц. )= 3SO2
+ 2Н2О
)= 3SO2
+ 2Н2О
3. Специфические свойства кислот зависят от входящего в состав кислоты аниона.
Ag+ +
Cl— = AgCl↓
белый творожистый осадок
Ba2+ +
SO42- =
BaSO4↓ белый мелкокристаллический
осадок
3Ag+ +
PO43- =
Ag3PO4↓
жёлтый осадок
2H+ +
S2- = H2S↑
газ с неприятным запахом тухлых яиц
4. Нестабильные кислоты разлагаются.
H2SO3 и H2CO3
в свободном виде не
существуют, разлагаются:
H2CO3 = H2O + CO2↑ газ без запаха
H2SiO3 — нерастворимая кислота.
 Разлагается при нагревании.
Разлагается при нагревании.
H2SiO3 = H2O + SiO2
ЗАДАНИЯ
Задание 1. Из приведённого перечня выберите
кислоты, назовите их, определите тип.
1) HNO2 2)
Li2O 3) H2S 4) CuSO4
5) P2O5 6) Al(OH)3 7) HCl 8) H2SO4
Задание 2. С какими из перечисленных веществ
может реагировать а) HCl б)
H2SO4(раствор)
1)Na2O 2)SO3
3)H2O 4) AgNO3 5)HNO3 6)Na2SO4
7)BaCl2 8)Mg 9)Cu 10) NaOH
ОТВЕТЫ.
Наверх
Кислоты — классификация, получение и свойства » HimEge.ru
Кислоты — электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка
Общая формула кислот HnAc, где n – число атомов водорода, равное заряду иона кислотного остатка, Ac — кислотный остаток.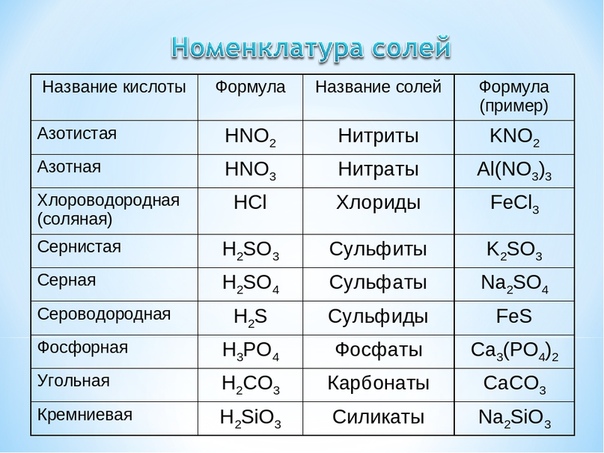
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3
Кислородосодержащие кислоты и соответствующие кислотные оксиды
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3.
1) Взаимодействие простых веществ
(получают бескислородные кислоты)
H2 + Cl2 = 2HCl,
H2 + S = H2S.
2) Взаимодействие кислотных оксидов с водой
(получают кислородсодержащие кислоты)
SO3 + H2O = H2SO4,
3) Взаимодействие солей с растворами сильных кислот
(получают слабые кислоты)
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl,
SiO32- + 2H+ = H2SiO3.
4) Электролиз водных растворов солей
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4.
1) Растворы кислот кислые на вкус, изменяют окраску индикаторов:
лакмуса в красный цвет, метилового оранжевого – в розовый, цвет фенолфталеина не изменяется.
В водном растворе растворимые кислоты диссоциируют, образуя ион водорода, и кислотный остаток:
HCl = H+ + Cl—.
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 = H+ + HSO4—,
HSO4— = H+ + SO42-.
Суммарное уравнение:
H2SO4 = 2H+ + SO42-
2) Взаимодействие с металлами
Ca + 2HCl = CaCl2 + H2
Водород из кислот-неокислителей могут вытеснять только металлы, стоящие в электрохимическом ряду напряжений металлов до водорода.
Кислоты-окислители — азотная и серная конц., реагируют с металлами по-другому, потому что в качестве окислителя выступает элемент кислотного остатка, а не водород!
Cu + 4HNO3 = Cu(NO3)2+ 2NO2↑+2H2O
Cu +2H2SO4 конц = CuSO4+SO2↑ + 2H2O
3) Взаимодействие с основными оксидами
CaO + 2HCl = CaCl2 + H2O
(если образуется растворимая соль)
4) Взаимодействие с основаниями (реакция нейтрализации)
H2SO4 + 2KOH = K2SO4 + 2H2O,
2H+ + 2OH— = 2H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O,
Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
Многоосновные кислоты образуют кислые и средние соли:
H2SO4 + NaOH = NaHSO4 + H2O,
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
5) Взаимодействие с солями
Реакции с солями происходят только в том случае, если в результате химического превращения образуется малодиссоциирующее вещество, выделяется газ или выпадает осадок.
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O,
CO32- + 2H+ = CO2 + H2O.
В этом случае выделяется углекислый газ и образуется малодиссоциирующее вещество – вода.
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4,
SiO32- + 2H+ = H2SiO3.
Реакция происходит, так как образуется осадок.
6) Специфические свойства кислот
Связаны с окислительно-восстановительными реакциями, бескислородные кислоты в растворе могут только окисляться (проявлять восстановительные свойства):
2KMn+7O4 + 16HCl— = Cl20 + 2KCl + 2Mn+2Cl2 + 8H2O,
H2S-2 + Br20 = S0 + 2HBr—.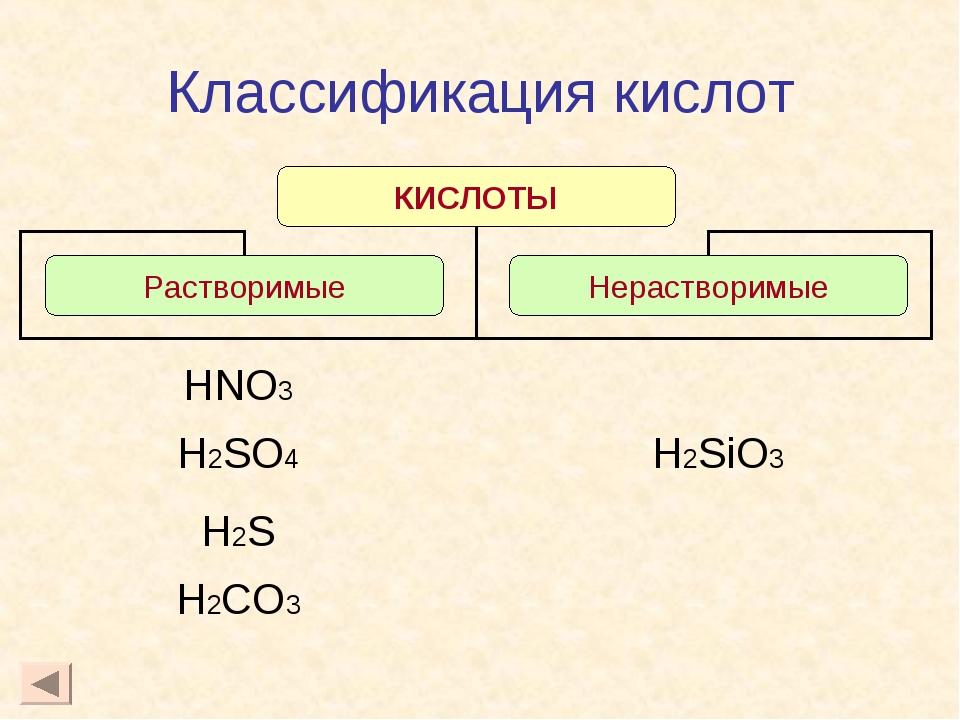
Кислородсодержащие кислоты могут окисляться (проявлять восстановительные свойства), только когда центральный атом в них находится в промежуточной степени окисления, как, например, в сернистой кислоте:
H2S+4O3 + Cl20 + H2O = H2S+6O4 + 2HCl—.
Если центральный атом находится в максимальной степени окисления, то кислоты проявляют окислительные свойства, например, взаимодействие с металлами и неметаллами:
C0 + 2H2S+6O4 = C+4O2 + 2S+4O2 + 2H2O,
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O.
Кислоты: классификация и химические свойства
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие (H2SO4 серная кислота, H2SO3 сернистая кислота, HNO3 азотная кислота, H3PO4 фосфорная кислота, H2CO3 угольная кислота, H2SiO3 кремниевая кислота) и бескислородные (HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, H2S сероводородная кислота).
В зависимости от числа атомов водорода в молекуле кислоты кислоты бывают одноосновные (с 1 атомом Н), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н). Например, азотная кислота HNO3 одноосновная, так как в молекуле её один атом водорода, серная кислота H2SO4 – двухосновная и т.д.
| К И С Л О Т Ы |
|
Одноосновные | Двухосновные | Трехосновные |
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Неорганических соединений, содержащих четыре атома водорода, способных замещаться на металл, очень мало.
Часть молекулы кислоты без водорода называется кислотным остатком.
Кислотные остатки могут состоять из одного атома (-Cl, -Br, -I) – это простые кислотные остатки, а могут – из группы атомов (-SO3, -PO4, -SiO3) – это сложные остатки.
В водных растворах при реакциях обмена и замещения кислотные остатки не разрушаются:
H2SO4 + CuCl2 → CuSO4 + 2 HCl↑
Слово ангидрид означает безводный, то есть кислота без воды. Например,
H2SO4 – H2O → SO3. Бескислородные кислоты ангидридов не имеют.
Своё название кислоты получают от названия образующего кислоту элемента (кислотообразователя) с прибавлением окончаний «ная» и реже «вая»: H2SO4 – серная; H2SO3 – угольная; H2SiO3 – кремниевая и т.д.
Элемент может образовать несколько кислородных кислот. В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
В таком случае указанные окончания в названии кислот будут тогда, когда элемент проявляет высшую валентность (в молекуле кислоты большое содержание атомов кислорода). Если элемент проявляет низшую валентность, окончание в названии кислоты будет «истая»: HNO3 – азотная, HNO2 – азотистая.
Кислоты можно получать растворением ангидридов в воде. В случае, если ангидриды в воде не растворимы, кислоту можно получить действием другой более сильной кислоты на соль необходимой кислоты. Этот способ характерен как для кислородных так и бескислородных кислот. Бескислородные кислоты получают так же прямым синтезом из водорода и неметалла с последующим растворением полученного соединения в воде:
H2 + Cl2 → 2 HCl;
H2 + S → H2S.
Растворы полученных газообразных веществ HCl и H2S и являются кислотами.
При обычных условиях кислоты бывают как в жидком, так и в твёрдом состоянии.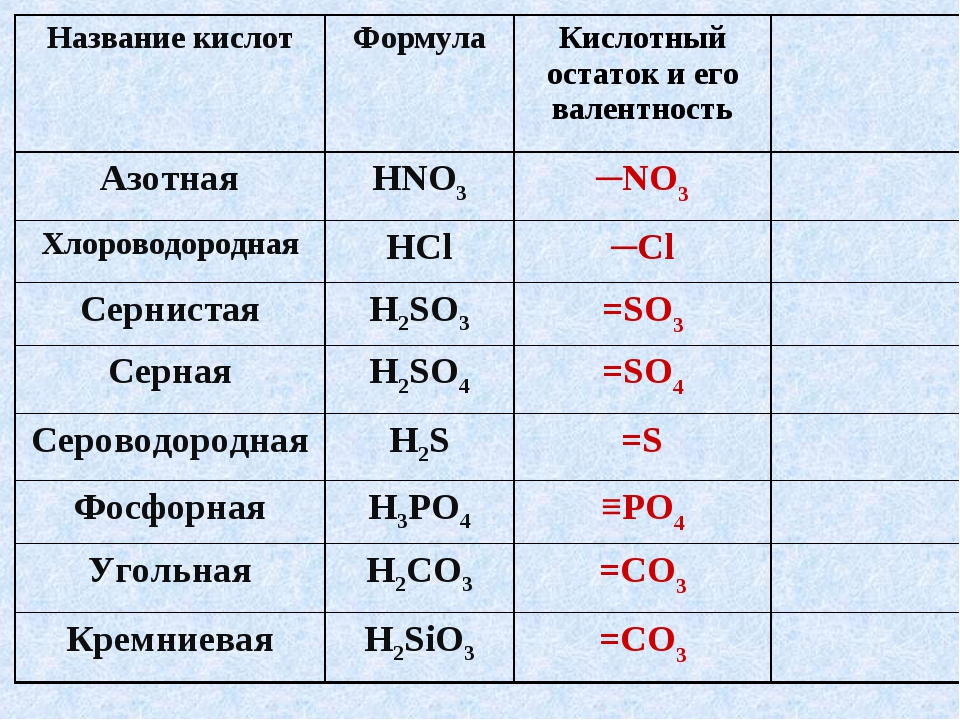
Химические свойства кислот
Растворыв кислот действуют на индикаторы. Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Индикаторы – это вещества сложного строения. Они меняют свою окраску в зависимоти от взаимодействия с разными химическими веществами. В нейтральных растворах — они имеют одну окраску, в растворах оснований – другую. При взаимодействии с кислотой они меняют свою окраску: индикатор метиловый оранжевый окрашивается в красный цвет, индикатор лакмус – тоже в красный цвет.
Взаимодействуют с основаниями с образованием воды и соли, в которой содержится неизменный кислотный остаток (реакция нейтрализации):
H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O.
Взаимодействуют с основанными оксидами с образованием воды и соли (реакция нейтрализации). Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H3PO4 + Fe2O3 → 2 FePO4 + 3 H2O.
Взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H+).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl2 + H2↑;
Cu + 4HNO3 → CuNO3 + 2 NO2 + 2 H2O.
Остались вопросы? Хотите знать больше о кислотах?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Беседа коллекционеров произведений искусства: зачем использовать бескислотную бумагу
Кредит изображения: Терилл Велч
Еще в 86 г. до н.э. в Китае рецепт изготовления бумаги не сильно изменилсяСогласно данным Музея бумажного производства Роберта К. Уильямса, бумага изначально была сделана из конопли, дерева, бамбуковых волокон и воды. Теперь он сделан из смеси древесной массы и воды с добавлением отбеливателя, чтобы он стал белым.
Химическое соединение в древесине под названием лигнин , смешанное с отбеливателем в процессе рафинирования, по мере старения бумаги превращается в соляную кислоту. Кислота разрушает химические соединения бумаги, в результате чего получаются желтые и ломкие газетные вырезки.
Кислота разрушает химические соединения бумаги, в результате чего получаются желтые и ломкие газетные вырезки.
В то время как желтые газетные вырезки и письма могут быть очаровательными, пожелтевшие отпечатки и холсты — нет. Этого повреждения можно избежать, используя не содержащую кислоту архивную бумагу, маты и материалы для обрамления.
Химические изменения происходят не только с изображением или печатьюНапример, отказ от использования бескислотного клея при обрамлении может привести к пожелтению обратной стороны холста, что повлияет на стоимость изделия.«Любая рамка вокруг произведения искусства должна быть архивной, то есть бескислотной бумагой, креплениями и клеями», — объясняет Дерек Смит, президент AXIS Fine Art Installation. Будучи экспертом в области обрамления, он подчеркнул важность использования бескислотных материалов для предотвращения видимого старения.
Архивная бумага была изобретена примерно в середине XIX века Поэтому, если вас беспокоит продукт начала 19 века или ранее, лучше проверить его уровень кислотности.
Проверка уровня pH бумаги позволит определить, является она кислой или нет. По шкале 0–14 все, что имеет значение pH 0–7, считается кислым, а 7–14 — нормальным. Хотя есть наборы, которые вы можете использовать для самопроверки, мы рекомендуем найти профессионала для проведения теста, например, в местной галерее или музее в вашем районе.
Бескислотные архивные материалы — это то, что должен понимать каждый коллекционер произведений искусства, чтобы способствовать долговечности своей коллекцииАрхивная бумага изготовлена из хлопкового волокна и имеет срок службы более 100 лет.До начала 19 века бумага в Соединенных Штатах всегда производилась из хлопкового волокна, что является одним из способов защиты ценных документов. Согласно Библиотеке Конгресса, кислая бумага стареет экспоненциально, то есть по мере увеличения количества кислоты в бумаге скорость процесса старения увеличивается.
Защитите свою коллекцию, узнав больше о потенциальном ущербе, нанесенном материалами в изделии.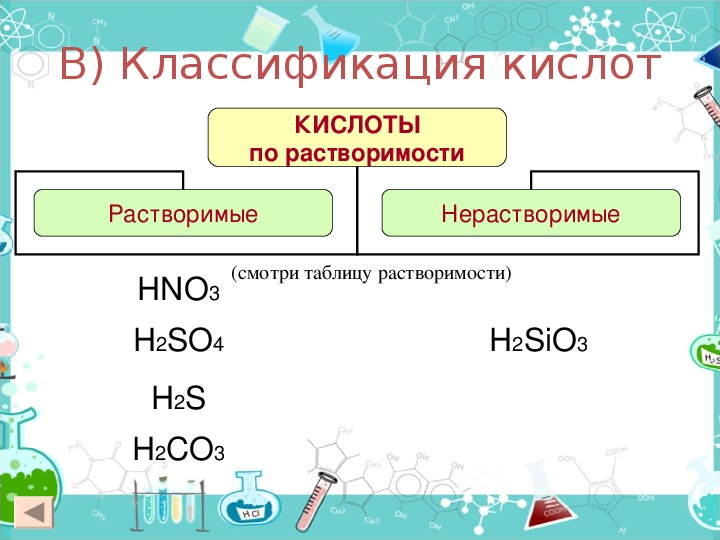 При следующей оценке попросите эксперта подтвердить, что ваши работы пройдут 100-летний рубеж.
При следующей оценке попросите эксперта подтвердить, что ваши работы пройдут 100-летний рубеж.
Узнайте больше о способах защиты и сохранения вашей коллекции. Загрузите нашу бесплатную электронную книгу Essential Guide to Collecting Art, чтобы получить дополнительные советы по консервации и хранению.
архивных определений: без кислоты | Буферизованный
(Для получения дополнительной информации щелкните каждое изображение в этом блоге.)
(Щелкните здесь, чтобы получить дополнительную информацию о вырезании оконных ковриков.)(Для получения дополнительной информации о выдвижных передних ящиках щелкните здесь)
Термин Acid Free часто встречается!
Но…
… всего ЧТО на самом деле означает «без кислоты» ???
Во-первых, небольшой обзор: помните уроки естествознания в 7-м классе все те миллионы лет назад?
Теперь просто КАК применимо к вашему…
Предметы коллекционирования • Произведения искусства • Семейные реликвии • Работы на бумаге • Фотографии • Ткани • Все остальное
(Щелкните каждое изображение ниже, чтобы получить дополнительную информацию и перейти к хорошо иллюстрированным блогам по конкретной теме. )
)
Высокое содержание кислоты может разрушить
ВАШИ Коллекции и архивыСодержание кислоты в бумаге — лучший показатель ее продолжительности жизни. Без кислоты означает, что pH бумаги составляет 7,0 (нейтральный) или выше (щелочной). Бескислотная бумага прослужит до 200 лет при нормальных условиях использования и хранения.
Что касается винтажной бумаги и картона, каждый из этих материалов по-разному реагирует на солнечный свет, температуру и влажность — чаще всего с пагубными последствиями. Со временем определенные химические вещества, которые либо присутствовали в бумаге естественным образом, либо, возможно, были введены во время производственного процесса, могут «активироваться», оказывая очень разрушительное воздействие на бумагу или картон.
Возможно, лучший пример того, как бумага «самоуничтожается изнутри» — это старая газетная бумага и бумага, используемая для изготовления многих старых книг конца 1800-х / начала 1900-х годов, большая часть которых сейчас пожелтела (если не коричневая) и очень хрупкий.
Лигнин — это встречающаяся в природе кислота, которая часто присутствует в суспензии древесной массы, используемой для создания бумаги. Пожелтение и ломкость старой бумаги происходит из-за того, что лигнин и другие остаточные кислоты «активируются» влажностью и температурой в процессе, который часто заканчивается разрушением самой бумаги.
Яркий пример высокого содержания кислоты в бумаге можно увидеть на фрагменте страницы ниже, взятом из старой книги о Первой мировой войне 1920 года.
Часть страницы из большой книги о Первой мировой войне, опубликованной примерно в 1920 году (точная дата не указана, поскольку титульный лист с информацией об издателе уже полностью распался).Книга буквально разваливается (!), И именно эта часть страницы развалилась у меня в руках, когда я попытался ее перевернуть. Вся книга такая же хрупкая из-за высокого содержания кислоты и лигнина на страницах (лигнин является естественным кислотным ингредиентом древесной массы). Также обратите внимание на сколы и трещины на бумаге по краям. Какой бардак!
Также обратите внимание на сколы и трещины на бумаге по краям. Какой бардак! Помимо того, что этот фрагмент «откололся» от большей страницы, этот фрагмент изначально был частью, когда при небольшом изгибе этот хрупкий, обожженный кислотой лист треснул и развалился, так как его структурная целостность была нарушена из-за высокого содержания кислоты в бумаге. .
Мало что можно сделать для снижения уровня внутреннего кислотного повреждения THAT , кроме как внимательно сканировать оригинал и делать копии, а затем, возможно, проконсультироваться с обученным профессиональным консерватором. (Щелкните здесь, чтобы перейти к нашему блогу под названием «Консерваторы — профессионалы, которых вы должны знать».)
Однако CAN может хранить важные семейные документы, предметы коллекционирования и произведения искусства в коробках, циновках, папках, конвертах ACID FREE и перемежать их с архивными тканями или бумагами.
ВСЕ картонных ковриков, коробок и корпусов музейного качества, предлагаемые Archival Methods, изготовлены из бескислотных материалов .
Кроме того, чтобы поддерживать безопасную долгосрочную архивную среду и свести к минимуму любую возможность «миграции кислоты» из ваших произведений искусства или артефактов, большинство наших бескислотных материалов «забуферены» 2–3% кальцием. карбонат.
Эта «буферизация» карбоната кальция обеспечивает нашим музейным качественным хранилищам и презентационным материалам безопасный для архивов pH 9 (± 0,5), который поможет нейтрализовать любые кислоты, которые могут мигрировать из ваших артефактов или произведений искусства.
В то время как «забуференные» бескислотные матовые доски / коробки / конверты / и прокладочные салфетки — это то, что обычно рекомендуется для большинства архивных хранилищ и презентаций, там — исключения — особенно для некоторых ткани и фотографические процессы.
При хранении тканей или артефактов на «растительной» основе (например, хлопка) можно использовать «буферные» или «небуферизованные» архивные ткани.
При хранении тканей или артефактов на «белковой» основе (таких как шелк или шерсть) всегда следует использовать «небуферизованные» архивные ткани, так как эти ткани не должны подвергаться прямому контакту со стандартными буферными агентами на 2-3% карбоната кальция. .
Как уже упоминалось, определенные фотографические процессы, такие как цианотипия (голубые отпечатки) и отпечатки с переносом красителя, «просто не любят» буферных агентов карбоната кальция, которые могут им навредить. Эти типы изображений следует чередовать с «небуферизованной» архивной тканью.
Цианотипы (см. Фото ниже) и отпечатки с переносом красителя также могут быть помещены в архивные полиэтиленовые пакеты, прежде чем они будут помещены в буферные бескислотные корпуса и коробки — архивный раствор PERFECT .
(Нажмите на изображение, чтобы перейти к нашему полностью иллюстрированному — и довольно забавному! — блогу «Открытки / Семейная история и архивное дело».)Следует отметить, что есть несколько более старых руководств по консервации фотографий, которые предполагают, что красители в химически обработанных цветных фотографических отпечатках могут быть повреждены воздействием буферных агентов карбоната кальция.
Однако более современные исследования показали, что обычно это не так — если только ваша цветная фотография И ваш прокладывающий материал ОБА не намокнет, см. Объяснение ниже.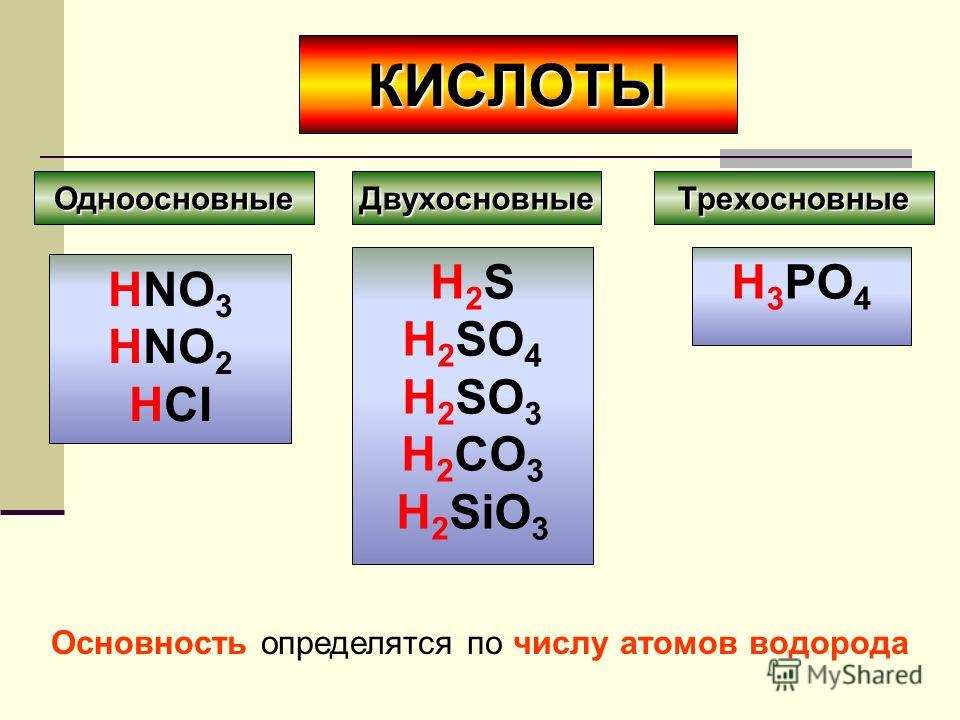
На практике, поскольку буферные агенты карбоната кальция не «мигрируют», как некоторые кислоты, использование «буферных» матов и чередование вполне нормально, поскольку требуется воздействие жидкой воды — как архивная прокладочная бумага, так и ткань И желатин слой самого отпечатка намокает — чтобы на отпечаток не попали буферные агенты.
(Нажмите на изображение, чтобы перейти в наш иллюстрированный блог «История ужасов / Архивные катастрофы» — УРА!) Поэтому использование «буферных» матов и чередования следует рассматривать для использования с цветными фотографиями, потому что, если ваш материал для чередования и сам отпечаток намокнут, у вас будут даже более серьезные проблемы , чем что-либо, вызванное потенциальным переносом буферных агентов.Однако, если вы все еще сомневаетесь, используйте «небуферизованную» архивную ткань.
Archival Methods не содержат лигнина и кислот и забуферены 3% карбонатом кальция».
ТЕПЕРЬ ВЫ ЗНАЕТЕ, ЧТО ВСЕ ЭТО ОЗНАЧАЕТ !!! Очень круто!
(Для получения дополнительной информации щелкните изображение.)
И вот, ребята, что происходит с терминами «без кислоты», / «с буфером», / и «без буферизации».”
Теперь вы поймете, что это означает, когда вы увидите эти термины в описании любого из тщательно протестированных продуктов музейного качества с гарантией.
Вы можете быть уверены, что ваши важные произведения искусства, фотографии, предметы коллекционирования, бумаги, ткани и артефакты из семейного архива будут надежно защищены для будущих поколений в их «бескислотных» корпусах, коробках и циновках.
Наконец, в качестве быстрого 5-минутного обзора всего упомянутого в этом блоге, пожалуйста, посмотрите наше короткое / исчерпывающее видео на YouTube об определениях / различиях методов архивирования : без кислоты / с буферизацией / без буферизации!
(Нажмите на это изображение, чтобы перейти к нашему короткому видео на YouTube об определениях / различиях методов архивирования: бескислотные / с буферизацией / без буферизации.
 )
) Свяжитесь с нами
Если у вас есть какие-либо дополнительные вопросы относительно «бескислотного» хранения или представления, или подходят ли «буферные» или «небуферизованные» материалы для ваших нужд и приложений, свяжитесь с нами здесь, в Archival Methods. Мы всегда готовы помочь с любыми вопросами по архивированию, хранению или презентации, которые могут у вас возникнуть.
Мы также хотели бы побудить вас подписаться на нас в Twitter, Facebook, Pinterest и в нашем большом количестве информативных и ярко иллюстрированных (и часто юмористических) блогов для получения самой последней информации и интересных историй.
Без кислоты — Узнайте о преимуществах использования бескислотных материалов
Что такое бескислотный и почему это важно?
Если кислотный продукт попадет на бумагу, фотографии,
текстильные изделия или другие подобные предметы, кислота может мигрировать,
вызывая непоправимый ущерб и распад. Вот почему это так
очень важно использовать хорошее качество без кислоты и архивировать
материалы для сохранения ваших заветных воспоминаний.
Вот почему это так
очень важно использовать хорошее качество без кислоты и архивировать
материалы для сохранения ваших заветных воспоминаний.
Хранение в архивных продуктах замедлит процесс старения и добавляйте годы жизни тем вещам, которые вы цените. Лучше предотвратить повреждение и ухудшение, чем пытаться отремонтировать или исправь это.
Если вы не используете настоящие бескислотные материалы, вы обнаружите, что ваши артефакты, документы и фотографии могут обесцветиться или распадаются быстрее, чем естественным образом.
Для хранения фото нужно дополнительно проверить что материалы, которые вы используете, безопасны для фотографий или прошли Тест PAT.
Архивное качество
Этот термин используется для обозначения того, что материалы имеют прошли лабораторный анализ, чтобы определить и подтвердить, что их кислотные и консервирующие свойства безопасны уровни.
Фактор pH
Это относится к кислотности бумаги. Шкала pH — это
эталон для измерения кислотности и щелочности. Это работает
от 1 до 14, где каждое число представляет десятикратный
увеличивать; pH нейтральный — 7.Бескислотные продукты имеют pH
фактор 7 или выше.
Это работает
от 1 до 14, где каждое число представляет десятикратный
увеличивать; pH нейтральный — 7.Бескислотные продукты имеют pH
фактор 7 или выше.
Тест PAT — Тест фотоактивности — Фото безопасен
Это термин, похожий на качество архивов, но более конкретный. к материалам, использованным с фотографиями.
Почему бумага портится?
До середины 19 века большинство бумаг делалось из тряпки или тряпки. сток ткани. Примерно в 1860 году бумажные фабрики начали использовать измельченная древесина с кислотами, отбеливателем и квасцей-канифолью в результате получается бумага с высоким содержанием кислоты (низкий pH).Эти бумага реагирует с водой и атмосферой с образованием саморазрушающие кислотные соединения. Эти кислоты действуют на бумагу, укорачивайте волокна, из-за чего они становятся хрупкими, обесцветиться и рассыпаться в пыль.
Что я могу сделать, чтобы не повредить мои ценности?
Вам необходимо хранить свои вещи в безопасных условиях. (Видеть
Рекомендации по сохранению), но, что не менее важно, вам необходимо
храните свои артефакты в надежных подлинных бескислотных коробках, например
Ящик для семейной истории или любой другой продукт в
Сборник «Воспоминания и ностальгия»..
(Видеть
Рекомендации по сохранению), но, что не менее важно, вам необходимо
храните свои артефакты в надежных подлинных бескислотных коробках, например
Ящик для семейной истории или любой другой продукт в
Сборник «Воспоминания и ностальгия»..
Если вы сомневаетесь, как ухаживать и хранить пункт, пожалуйста, проконсультируйтесь с профессиональным консерватором для конкретных совет.
Для получения более подробной информации об уходе и сохранении ряда различных материалов или предметов, см. отличные статьи на www.conservationregister.com
Отличную статью о консервации можно увидеть на
Сайт музеев Ливерпуля под названием Прошедшее настоящее будущее.
Архивный глоссарий
Часто используемые термины и их значение
Этот глоссарий призван помочь вам сделать осознанный выбор материалов, которые вы должны использовать для сохранения книг, бумаг, фотографий и других артефактов в вашей коллекции. Обратите внимание, что этот глоссарий написан нетехническими терминами, чтобы помочь тем, у кого нет обучения уходу за коллекциями, выполнить возложенные на них обязанности.
А
Кислота: В химии кислота — это вещество, способное образовывать ионы водорода при растворении в воде.Кислоты могут ослабить целлюлозу в бумаге, картоне и ткани, что приведет к их охрупчиванию. Кислоты могут присутствовать в материалах либо намеренно, с использованием низкокачественных ингредиентов, либо случайно, за счет миграции кислот из других материалов или из-за загрязнения атмосферы. См. Также pH и миграцию кислоты.
Бескислотный: В химии материалы с pH 7,0 или выше считаются бескислотными. Иногда неправильно используется как синоним щелочного или буферного. Такие материалы можно производить практически из любого источника целлюлозного волокна (среди прочего, хлопка и дерева), если во время производства будут приняты меры по удалению активной кислоты из целлюлозы.Как бы то ни было, без кислоты бумага или картон могут быть сразу после производства, с течением времени присутствие остаточного хлора от отбеливания, сульфата алюминия от проклейки или загрязняющих веществ в атмосфере может привести к образованию кислоты, если бумага или картон не были забуферены.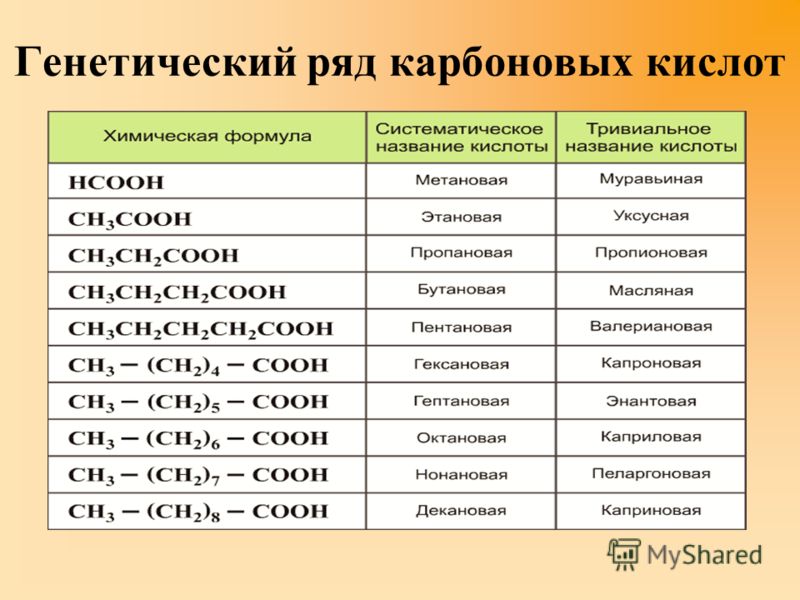 щелочное вещество.
щелочное вещество.
Миграция кислоты: Перенос кислоты из кислого материала в менее кислый или рН-нейтральный материал известен как миграция кислоты. Это может произойти напрямую, когда два материала находятся в тесном контакте.Например, кислота может мигрировать из упаковки или вспомогательных материалов, коробок и других корпусов, в которых хранится документ, книга или артефакт.
Акрил: Пластик, отличающийся прозрачностью, легкостью, атмосферостойкостью, стойкостью цвета и жесткостью. В дополнение к этим качествам акрил важен для консервации из-за его стабильности или устойчивости к химическим изменениям с течением времени; характеристика, присущая не всем пластмассам. Акриловые краски доступны в виде листов, пленок и полимерных клеев.
Щелочные: Щелочные вещества имеют pH более 7,0. Эти вещества могут быть добавлены к материалу для нейтрализации кислот или в качестве щелочного резерва или буфера с целью противодействия кислотам, которые могут образоваться в будущем. Буфер может быть добавлен во время производства или в процессе нейтрализации кислотности. Хотя в качестве буферов можно использовать ряд химических веществ, наиболее распространенными являются карбонат магния и карбонат кальция.
Буфер может быть добавлен во время производства или в процессе нейтрализации кислотности. Хотя в качестве буферов можно использовать ряд химических веществ, наиболее распространенными являются карбонат магния и карбонат кальция.
Альфа-целлюлоза: Форма целлюлозы, полученная из хлопка.Присутствие альфа-целлюлозы в бумаге или картоне является одним из показателей ее стабильности или долговечности. Считается, что нецеллюлозные компоненты древесины способствуют разрушению бумаги и картона.
Archival (Архивное качество): Этот нетехнический термин означает, что материал или продукт являются постоянными, долговечными или химически стабильными, и поэтому их можно безопасно использовать в целях сохранения. Фраза не поддается количественной оценке; не существует стандартов, описывающих, как долго прослужит материал «архивного» или «архивного качества».
Наверх
В
Базовый вес: Базовый вес — это вес одной пачки (500 листов) бумаги, выраженный в фунтах.
Доска: См. ДВП или массивная плита
Буферизация: Бумага и картон делятся на буферизованные и небуферизованные. Карбонат кальция — предпочтительный буферный агент профессионалов консервации. Буферный агент помогает нейтрализовать кислоты в окружающей среде и помогает предотвратить их воздействие на ваши коллекции.Из-за опасений по поводу воздействия буферных агентов на некоторые продукты животного происхождения, такие как шерсть, кожа и шелк, эти материалы. Небуферизованные материалы для хранения также рекомендуются для некоторых редких коллекций фотографий, включая перенос красителей и цианотипии. Примечание: небуферированные материалы могут поглощать кислоты из окружающей среды и в конечном итоге сами могут стать кислыми.
Наверх
С
Карбонат кальция: Карбонат кальция, предпочтительный буферный агент для специалистов по консервации, добавляется в бумажную массу в процессе изготовления бумаги для нейтрализации кислот. Его присутствие в папках, коробках и других вложениях помогает нейтрализовать кислоты в окружающей среде.
Его присутствие в папках, коробках и других вложениях помогает нейтрализовать кислоты в окружающей среде.
Штангенциркуль: Штангенциркуль или просто точки — это единица измерения толщины бумаги. Одна точка штангенциркуля равна одной тысячной дюйма.
Целлюлоза: Основной составляющей клеточных стенок всех растений является целлюлоза, и как таковая она является основным компонентом многих волокнистых растительных продуктов, включая бумагу, картон и некоторую одежду.
Химическая стабильность: Не легко разлагается или химически не модифицируется иным образом. Это желательная характеристика для материалов, используемых при консервации, поскольку она предполагает способность противостоять химическому разложению (например, охрупчиванию бумаги) с течением времени и / или при воздействии различных условий во время использования или хранения. Другие термины, свободно используемые как синонимы, включают инертный, стабильный и химически инертный.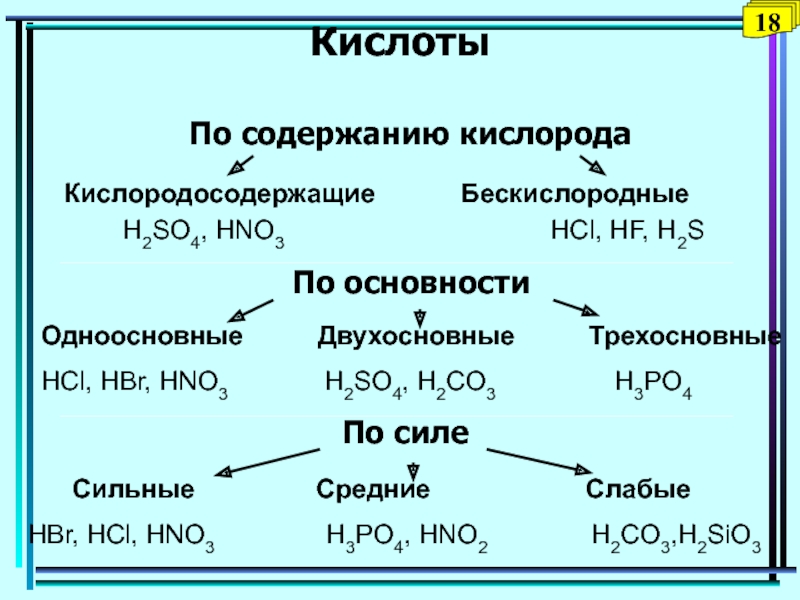
Консервация: Обработка библиотечных или архивных материалов, произведений искусства, артефактов и музейных предметов для их химической стабилизации или их физического укрепления, чтобы они как можно дольше сохраняли свою первоначальную форму.
Наверх
D
Раскисление: Общий термин для химической обработки, которая нейтрализует кислоту в таком материале, как бумага, и оставляет щелочной буфер, чтобы противодействовать будущей кислотной атаке. Хотя раскисление увеличивает химическую стабильность бумаги, оно не восстанавливает прочность или гибкость хрупких материалов.
Наверх
E
Инкапсуляция: Форма защитного кожуха для бумаги и других плоских предметов, эта процедура включает размещение предмета между двумя листами прозрачной полиэфирной пленки и герметизацию по краям.Таким образом, объект физически поддерживается и защищен от атмосферы, хотя он может продолжать разрушаться в капсуле, если он не был должным образом нейтрализован. Поскольку объект не прилипает к полиэстеру, его можно удалить, просто отрезав один или несколько краев корпуса из полиэстера.
Поскольку объект не прилипает к полиэстеру, его можно удалить, просто отрезав один или несколько краев корпуса из полиэстера.
Наверх
F
Содержание волокна: Указание типов и процентного содержания волокон, используемых при производстве бумаги, картона или одежды. Содержание волокна важно, поскольку оно влияет как на долговечность, так и на химическую стабильность материала.
ДВП: Картон из многослойных листов сильно прессованного волокна.
Наверх
г
Направление зерна: Представляет ориентацию волокон в бумаге. Бумага имеет естественную тенденцию складываться «вместе с волокнами», что обычно позволяет легко определить направление волокон, с которым вы работаете. Направление волокон можно считать коротким или длинным, в зависимости от того, идет ли оно параллельно длинной или короткой стороне бумаги.
я
Инертный: См. Химическую стабильность.
Наверх
L
Лигнин (без лигнина): Лигнин — это природное вещество, которое содержится в растениях и обеспечивает жесткость. В некоторых кругах считается, что лигнин способствует раннему разложению бумаги и часто удаляется в процессе варки целлюлозы для создания бумаги более высокого качества.
Наверх
M
Mil: Эта единица измерения равна одной тысячной дюйма (.002).
Наверх
N
Нейтральный: Имеет уровень pH около 7, не является ни кислым, ни щелочным.
Наверх
П
Стойкость: — это способность материала сопротивляться химическому разрушению, но не поддающийся количественной оценке термин. Перманентная бумага обычно относится к прочной щелочной бумаге, которая производится в соответствии со стандартами ANSI. Даже так называемые постоянные материалы зависят от надлежащих условий хранения, чтобы поддерживать их постоянство.
pH (присутствие водорода): В химии pH — это мера концентрации ионов водорода, которая является мерой кислотности или щелочности. Шкала pH варьируется от 1 до 14, где 7 соответствует нейтральному уровню pH; числа ниже 7 указывают на возрастающую кислотность, при этом 1 означает наиболее кислотную реакцию, числа выше 7 указывают на возрастающую щелочность, а 14 — наиболее щелочную. Каждое число, отличное от 8, означает десятикратное увеличение. Бумага с pH ниже 5 считается очень кислой.
Тест фотоактивности (PAT): PAT — это тест ускоренного старения, который прогнозирует влияние материала на фотографические изображения.По сути, он предсказывает тип взаимодействия между корпусом и фотоматериалами и определяет, окажет ли какой-либо из компонентов корпуса, включая клеи, чернила, бумагу и пластик, негативное влияние на фотографию, негатив или другие фотоматериалы.
Полиэстер: Полиэстер давно известен как кристально чистый инертный пластиковый лист, который можно использовать для создания ограждений для длительного хранения. Mylar D, торговая марка, долгое время считавшаяся ведущей маркой полиэстера, была снята с производства в пользу другого бренда, Mellinex — полиэстера такого же высокого качества.Другие марки полиэстера без покрытия также могут считаться подходящими для целей консервации.
Mylar D, торговая марка, долгое время считавшаяся ведущей маркой полиэстера, была снята с производства в пользу другого бренда, Mellinex — полиэстера такого же высокого качества.Другие марки полиэстера без покрытия также могут считаться подходящими для целей консервации.
Поливинилхлорид (ПВХ): Это химическое вещество, которое присутствует в некоторых типах пластмасс, при разложении может выделять разрушительную соляную кислоту, вызывая повреждение хранящихся внутри материалов. ПВХ часто издает сильный запах, например, от новой пластиковой занавески для душа.
Полипропилен: Подходящий инертный пластик для архивного хранения, обычно связанный со страницами, используемыми для хранения или отображения фотографий и негативов в альбомах для вырезок или альбомов.
Поливинилацетат: Пластик, обычно обозначаемый аббревиатурой ПВА, который представляет собой бесцветное и прозрачное твердое вещество. Он часто используется в клеях, которые сами называются ПВА или ПВА. Существует множество клеев ПВА, некоторые из них пластифицированы изнутри и подходят для использования в консервации благодаря хорошей химической стабильности среди других качеств.
Существует множество клеев ПВА, некоторые из них пластифицированы изнутри и подходят для использования в консервации благодаря хорошей химической стабильности среди других качеств.
Сохранность: Описывает деятельность, связанную с поддержанием библиотечных, архивных или музейных материалов для использования в их первоначальной физической форме или в каком-либо другом формате.Сохранение считается более широким термином, чем сохранение.
Наверх
R
Обратимость: Этот термин относится к способности отменить процесс или обработку без изменения объекта. Обратимость — важная цель консервативного лечения, но она должна быть сбалансирована с другими целями и вариантами лечения.
Наверх
S
Сплошной картон: Этот картон сделан из одного материала.Твердый картон отличается от комбинированного картона, в котором используются или ламинируются слоями два или более типов волокнистого материала.
Наверх
Т
Термогигрометры: Этот термин относится к любому количеству приборов, которые измеряют уровни температуры и влажности в помещении, где находятся коллекции. Постоянные и контролируемые уровни температуры и влажности необходимы для длительного выживания коллекций. Развитие технологий привело к появлению более точных и дешевых инструментов, включая регистраторы данных.
Наверх
U
УФ-фильтр: Этот материал используется для фильтрации ультрафиолетовых (УФ) лучей из видимого света. Ультрафиолетовое излучение потенциально опасно для библиотечных, архивных и музейных предметов и присутствует в солнечном свете, флуоресцентном свете, а также в свете ламп накаливания. Удаление ультрафиолетового излучения из помещений для хранения, использования и выставок может снизить скорость порчи артефактов. УФ-фильтрующий материал помещается на окна и люминесцентные лампы или используется в качестве остекления в обрамлении и выставочных витринах.
Вернуться к началу
Lenz Arts — Обрамление -> Условия сохранения
Определения некоторых терминов по консервации и обрамлению
Эндрю Т. Ленц-младший
Эти определения призваны помочь вам понять некоторые основные концепции, касающиеся сохранения.
Американский институт охраны природы в 2000 году пересмотрел одну из своих брошюр «Уход за произведениями искусства на бумаге», включив в нее несколько изменений, рекомендованных Эндрю.
Без кислоты
Технически материал с pH 7 или выше считается бескислотным. Кислоты опасны для создателей. Картон, например, имеет очень высокое содержание кислоты, что делает его непригодным для консервационных или любых других обрамлений. Кислоты со временем вызывают появление пятен на бумаге и ее ломкость.
Утверждается, что некоторые обычные маты имеют бескислотную сердцевину и бумажную основу. Сделать его полностью свободным от кислоты, верно? Ну нет. Хотя это лучше, чем ничего, доски все же содержат лигнин, который в дальнейшем приводит к более кислой основе. Эти обычные доски забуферены карбонатом кальция для нейтрализации существующих кислот, но со временем этот буфер будет переполнен. Также имейте в виду, что поверхность бумаги не является бескислотной и выделяет загрязняющие вещества, а для окраски поверхности используются красители, которые быстро тускнеют по сравнению с пигментами.
Хотя это лучше, чем ничего, доски все же содержат лигнин, который в дальнейшем приводит к более кислой основе. Эти обычные доски забуферены карбонатом кальция для нейтрализации существующих кислот, но со временем этот буфер будет переполнен. Также имейте в виду, что поверхность бумаги не является бескислотной и выделяет загрязняющие вещества, а для окраски поверхности используются красители, которые быстро тускнеют по сравнению с пигментами.
Доски для консервации полностью не содержат кислоты в общепринятом смысле этого слова.
Альфа-целлюлоза
Это целлюлоза растений (обычно древесная), которая была очищена, удаляя лигнин и другие потенциально опасные вещества, оставляя почти чистую целлюлозу с нейтральным pH.
Alphamat
Alphamat — торговая марка консервационной матовой доски, производимой Nielsen & Bainbridge. Он состоит из альфа-целлюлозы, поверхность бумаги окрашена с использованием светостойких пигментов, а картон является частью семейства продуктов Artcare, в которых используется технология MicroChamber.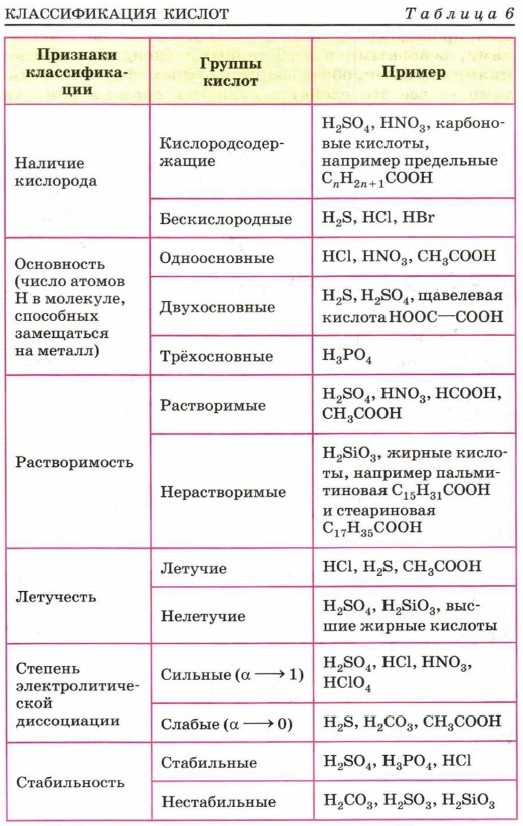
Квасцы
Это химическое вещество, которое иногда используется для закрепления красителей и проклейки (адгезивов) при производстве бумаги. Квасцы не являются архивным веществом и обладают кислотностью. Ни один из консервационных ковриков или консервационных материалов не содержит квасцов.
Архивный
По соглашению, термин «архивирование» применительно к обрамлению обычно считается синонимом консервационного или консервационного обрамления. Если что-то делается с использованием архивных методов, это делается таким образом, чтобы произведение искусства сохранялось наилучшим образом или, по крайней мере, способом, подходящим для архива — хранилища для предметов, предназначенных для сохранения.Кто-то может возразить, что не существует такой вещи, как архивное оформление, поскольку настоящий архив не выставлял бы что-то на обозрение, а хранил бы это в безопасном контейнере вдали от потенциально опасного света.
Artcare
Artcare является товарным знаком Artcare (UK) Limited, используемым по лицензии компанией Nielsen & Bainbridge, LLC.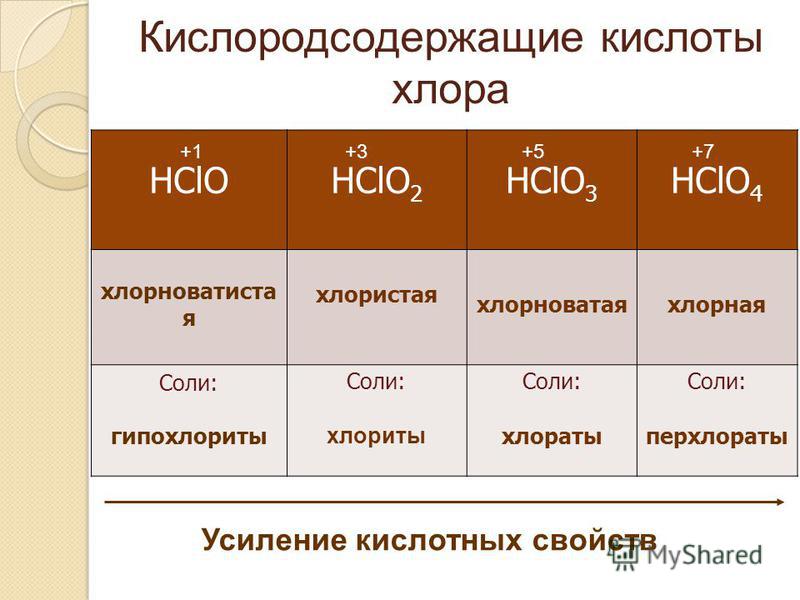 См. Технология MicroChamber.
См. Технология MicroChamber.
Буфер
Буферный агент — это вещество, добавляемое к бумажному изделию для нейтрализации существующих кислот или для поддержания щелочного pH с течением времени.Через несколько лет из-за внешних загрязнителей действительно архивный картон может стать кислым, даже если он не содержит внутри ничего, что могло бы вызвать образование кислоты, а буферные растворы помогают задержать достижение картоном кислого уровня pH. Двумя распространенными буферами, нейтрализующими кислоту, являются карбонат кальция и карбонат магния. Буфер создает то, что также иногда называют щелочным резервом, то есть количество, превышающее то, что требуется для создания нейтрального состояния pH в бумаге. Интересно отметить, что некоторые редкие винтажные фотографии плохо реагируют на щелочность буферов и лучше всего кадрировать с использованием небуферизованных плат с нейтральным pH.
Карбонат кальция
См. Буфер.
Скручивание
Это означает просто искривление или изгибание плоского предмета искусства.
Консервационное обрамление
Консервационное обрамление подготавливает элемент к отображению таким образом, чтобы сохранить этот предмет, сохраняя его в максимально возможной степени неизменным, одновременно защищая его от деградации. В идеале все, что делается с произведением искусства, должно быть полностью обратимым, позволяя произведению искусства вернуться в исходное состояние, поскольку оно никогда не было обрамлено.
Консерватор
Консерватор — это физическое лицо, которое специализируется на уходе за произведениями искусства и их обработке, например на реставрации или ремонте поврежденных произведений искусства. Консерваторы проходят годы обучения и ученичества.
Разработчики, как правило, не занимаются консервированием. Это старая история о «попытке служить двум господам». Хотя некоторые создатели могут быть достаточно хорошо осведомлены в обращении с произведениями искусства, прежде чем использовать создателя, утверждающего, что он консерватор или который готов взять на себя ремонт ценных произведений искусства, я рекомендую сначала проконсультироваться с постоянными консерваторами, чтобы найти ссылки на создателя.
Также я лично не позволил бы консерватору сделать мое обрамление. К сожалению, некоторые из наиболее плохо скроенных циновок находятся в музеях после того, как их сделали реставраторы.
Кстати, по той же причине я не позволил бы фотографу кадрировать мои фотографии.
Лисица
Лисица — это просто небольшие коричневые пятна среднего цвета, которые вы обычно видите на очень старой бумаге. Это наросты на бумаге из-за влаги и тепла. Их может отбелить консерватор, хотя многие консерваторы рекомендуют оставить их в покое.Вы можете снизить риск лисицы, который может развиться даже на новых произведениях искусства, повесив их в помещении без высокой влажности. Это может быть сложно, если в вашем доме мало солнечного света. Если вы легко заразились плесенью в определенной части дома, не вешайте туда ценные картины.
Петли
Петли — это изделие из бумаги или ткани, используемое для фиксации произведения искусства на месте. Легче всего перевернуть из японской папиросной бумаги, приклеенной пастой из пшеничного крахмала — это трудно для неопытных людей сделать с большинством бумажных произведений искусства, так как попадание влаги может привести к изгибу произведений искусства в местах расположения петель, особенно на более тонкие бумаги.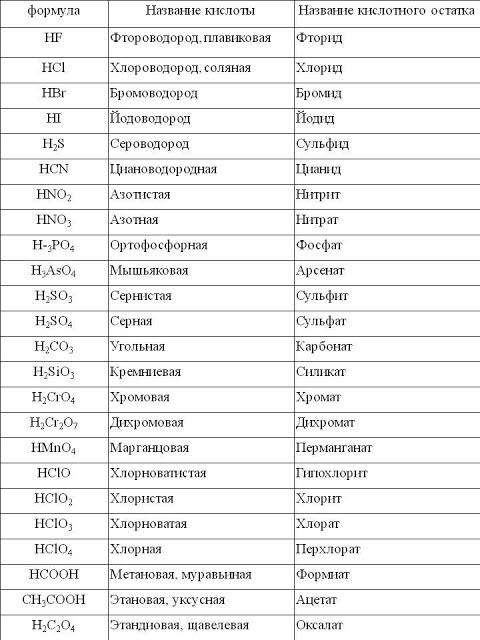 Петли должны быть водоотталкивающими и иметь нейтральный уровень pH. В идеале петли должны быть слабее, чем произведение искусства, поскольку идея состоит в том, что при падении пакета обрамления первыми порвутся петли, а не произведение искусства. Малярная лента — это худшая лента, которую вы можете использовать для петель, скотч, изолента и упаковочные ленты не отстают.
Петли должны быть водоотталкивающими и иметь нейтральный уровень pH. В идеале петли должны быть слабее, чем произведение искусства, поскольку идея состоит в том, что при падении пакета обрамления первыми порвутся петли, а не произведение искусства. Малярная лента — это худшая лента, которую вы можете использовать для петель, скотч, изолента и упаковочные ленты не отстают.
Lightfast
Бумага, устойчивая к выцветанию, считается светостойкой. Бумаги окрашиваются красителями или пигментами. Красители не светостойкие, однако большинство пигментов менее летучие, чем красители, и лучше сохраняют свой первоначальный цвет.Под воздействием света красный цвет постепенно меняется на розовый. Скорость этого перехода зависит от того, насколько устойчив краситель или пигмент к выцветанию. Но почти все блекнет, это просто вопрос времени и выдержки.
Лигнин
Это естественная часть древесной массы, которая прекрасно выделяет кислоты. Следовательно, это плохо для обрамления, и вы хотите, чтобы любые бумажные изделия не содержали лигнина. Хлопок (иногда называемый тряпичной доской, естественно, так, и альфа-целлюлоза также не содержит лигнина.
Хлопок (иногда называемый тряпичной доской, естественно, так, и альфа-целлюлоза также не содержит лигнина.
Карбонат магния
См. Буфер.
MicroChamber Technology
Цеолиты — это небольшие молекулярные ловушки (микрокамеры), которые улавливают переносимые по воздуху загрязнители и превращают их в инертное вещество. При производстве матов газы, выделяемые стареющими деревянными каркасами или другими кислотными материалами, не будут свободно плавать, чтобы повредить произведения искусства. Линия продуктов Artcare, производимая Nielsen & Bainbridge, включает эту технологию.
Выхлопные газы
По мере старения материалов они выделяют газы, обычно вредные.Этот процесс называется дегазированием. Эти выделенные загрязнители способствуют ускоренному разрушению материалов вокруг него. Эффекты газовыделения можно уменьшить, используя плату с технологией MicroChamber, такую как Alphamat.
pH нейтральный
Шкала pH используется для обозначения кислотности или щелочности конкретного объекта. Значение pH 7,0 находится точно в центре шкалы и считается нейтральным. Например, более низкий pH, равный 6, является кислым. Более высокий pH, такой как 8, является щелочным и не так опасен для произведений искусства, однако очень высокий pH также может вызвать проблемы.Большинство консервационных матов имеют буфер до pH около 8,5. Эта сумма выше 7,0 называется резервом.
Значение pH 7,0 находится точно в центре шкалы и считается нейтральным. Например, более низкий pH, равный 6, является кислым. Более высокий pH, такой как 8, является щелочным и не так опасен для произведений искусства, однако очень высокий pH также может вызвать проблемы.Большинство консервационных матов имеют буфер до pH около 8,5. Эта сумма выше 7,0 называется резервом.
Консервация
См. Консервация.
Тряпичная доска
На самом деле это устаревший термин, который до сих пор используется в качестве условного. 100% хлопковые плиты когда-то делались из старой тряпки. В наши дни музейные доски изготавливаются из хлопкового линта, который представляет собой волокна, оставшиеся на семенах хлопка после того, как они были пропущены через хлопкоочистительную машину. Волокна на самом деле все еще слишком длинные, чтобы их можно было использовать на этом этапе, и их укорачивают перед изготовлением доски.Волокна хлопка все еще относительно длинные по сравнению с другими типами волокон, и в результате получается прочный, хотя и относительно мягкий картон.
RagMat
RagMat — торговая марка консервационного матового картона, производимого Crescent. Он состоит из хлопка, поверхность бумаги окрашена светостойкими пигментами.
Резерв
Буферы используются для создания так называемого щелочного резерва, то есть количества, превышающего (или «запасного») того, что требуется для создания нейтрального состояния pH в бумаге.
Цеолиты
См. MicroChamber Technology.
Есть вопросы о других условиях консервации? Не стесняйтесь связаться с нами.
Бумага HP — бумага без кислоты и лигнина
Область консервирования бумаги постоянно меняется по мере разработки новых видов бумаги и развития производства бумаги. При разработке новой специальной бумаги для струйных принтеров возникла необходимость понять факторы, определяющие возможность архивирования бумаги.
Многие потребители узнают о таких модных словах, как «кислотность» и «содержание лигнина» (см. Термины и определения в производстве бумаги), и они понимают, что эти слова относятся к факторам, которые так или иначе снижают долговечность бумаги. Потребителей также смущают противоречивые сообщения производителей бумаги о том, как кислота и лигнин влияют на сохранность бумаги и текста или изображений, напечатанных на бумаге. Кроме того, множество организаций бумажной промышленности используют различные стандарты в отношении воздействия кислоты и лигнина на сохранность бумаги. В результате у потребителей возникает много вопросов по поводу утверждений о том, что бумага не содержит кислоты и лигнина, в том числе:
Потребителей также смущают противоречивые сообщения производителей бумаги о том, как кислота и лигнин влияют на сохранность бумаги и текста или изображений, напечатанных на бумаге. Кроме того, множество организаций бумажной промышленности используют различные стандарты в отношении воздействия кислоты и лигнина на сохранность бумаги. В результате у потребителей возникает много вопросов по поводу утверждений о том, что бумага не содержит кислоты и лигнина, в том числе:
На чем основаны эти утверждения?
Как долго документ или фотография останутся нетронутыми?
Какие еще факторы влияют на постоянство документов и фотографий?
Как лидер в области фотобумаги и специальной бумаги для струйных принтеров, позиция Hewlett-Packard (HP) по кислотности и содержанию лигнина необходима для обеспечения ясности на запутанном рынке.HP признает, что традиционные заявления бумажной промышленности о бескислотной бумаге основаны на щелочном процессе, используемом для изготовления бумаги-основы (подложки), но не учитывают покрытие, которое наносится на бумагу.
В прошлом во многих процессах варки целлюлозы использовалась обработка сильной кислотой для отделения лигнина от целлюлозных волокон; это создало бумаги, которые быстро деградировали. В результате традиционное определение бескислотной бумаги стало использоваться для описания бумаги, изготовленной с помощью процессов производства некислотной бумаги; у этих бескислотных бумажных подложек меньше шансов разрушиться с возрастом.Бескислотные материалы считались безопасными для контакта с другими материалами, поскольку они не вызывали разложения, связанного с кислотой. Таким образом, «бескислотная бумага» стала традиционным термином, синонимом долговечной бумаги или бумаги архивного качества.
К сожалению, традиционное определение бескислотной бумаги может иметь ограниченное применение ко многим современным мелованным бумагам, предназначенным для печати и сохранения изображений. Современная бумага часто не использует сильные кислоты в процессе изготовления бумаги, но может использовать слабые кислоты в процессе нанесения покрытия. Эти слабые кислоты не обязательно увеличивают разложение бумаги, но они влияют на значение pH (см. Термины и определения для изготовления бумаги ниже) бумаги. Следовательно, современные бумаги могут соответствовать или не соответствовать традиционному определению бескислотной, но все же могут подходить для архивных целей.
Эти слабые кислоты не обязательно увеличивают разложение бумаги, но они влияют на значение pH (см. Термины и определения для изготовления бумаги ниже) бумаги. Следовательно, современные бумаги могут соответствовать или не соответствовать традиционному определению бескислотной, но все же могут подходить для архивных целей.
Подавляющее большинство фотобумаги и специальной бумаги HP для струйных принтеров соответствуют традиционному определению бескислотной и не содержащей лигнина бумаги, поскольку ее основы производятся щелочными процессами и содержат не более одного процента лигнина (см. Таблицу ниже).Хотя эти документы представляют собой конкурентоспособное решение для архивирования фотографий и ценных документов, HP считает, что вопрос архивирования является сложным и не был решен с должным уровнем сложности. HP также согласна с рекомендацией Международной организации по стандартизации (ISO) о том, что бумага, продаваемая как не содержащая лигнина, должна содержать не более одного процента лигнина.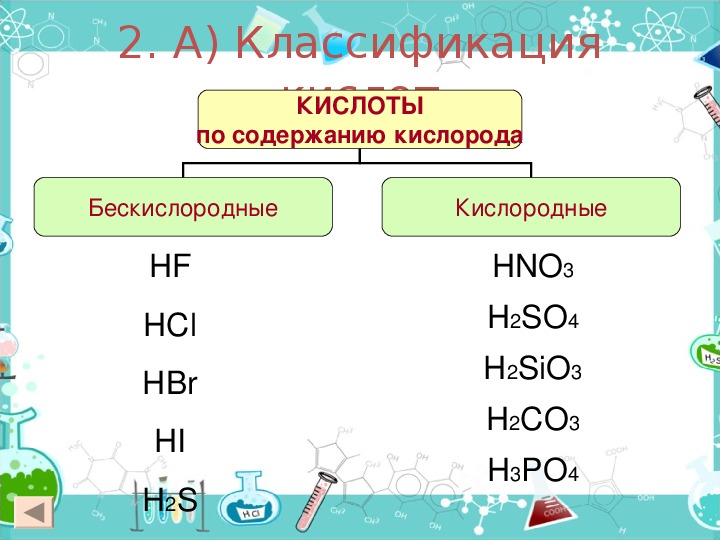
Стремясь помочь отрасли переопределить или заменить термин «бескислотный», HP продолжает исследования по моделированию старения, чтобы лучше понять, как на стойкость современной бумаги влияют лигнин, различные типы и количества кислот для покрытия и другие архивные факторы.Приверженность HP исследованиям на стойкость бумаги отражает их стремление производить лучшую фотобумагу и специальную бумагу для струйных принтеров.
Следующая таблица представляет собой сравнительный список процесса производства бескислотной бумаги и содержания лигнина во многих фотобумагах и специальной бумаге HP для струйных принтеров. Для объяснения некоторых ключевых терминов в производстве бумаги см. Термины и определения в производстве бумаги ниже.
Название продукта | * Соответствует традиционному промышленному определению «бескислотный»? | ** Без лигнина? |
Фотобумага HP высшего качества, глянцевая | Есть | Есть |
Фотобумага HP высшего качества, матовая | Есть | Есть |
Фотобумага HP высшего качества, глянцевая (4 x 6) | Есть | Есть |
Фотобумага HP повышенного качества, глянцевая | Есть | Есть |
Фотобумага HP, глянцевая | № | Есть |
Фотобумага HP для повседневного использования, полуглянцевая | Есть | Есть |
Фотобумага HP для повседневного использования, матовая | № | Есть |
Текстурированные поздравительные открытки HP | Есть | Есть |
Фотокарточки HP, складываемые пополам | № | Есть |
Бумага HP для брошюр и флаеров, глянцевая | Есть | Есть |
Бумага HP для брошюр и флаеров, матовая | № | Есть |
Бумага HP повышенного качества для струйной печати | № | Есть |
Плотная бумага HP повышенного качества для струйной печати | № | Есть |
* Произведено с использованием щелочного процесса. ** Содержание лигнина не более одного процента. | ||
свободных жирных кислот — обзор
4.7.3.4 Кровоток и поступление альбумина
Высвобождение FFA (но не глицерина) из жировой ткани снижается, когда кровоток через ткань ограничен (Kovach et al., 1976; Belfrage et al., 1979). Влияние ограничения крови на высвобождение FFA из жировой ткани, вероятно, связано с уменьшением доступности альбумина, как было первоначально показано в исследованиях перфузии жировой ткани крыс (см. Scow and Chernick, 1970) и подтверждено Bülow и Madsen (1981) на собаках. паховая жировая подушечка перфузируется дефибринированной кровью in situ. Альбумин имеет два относительно высокоаффинных сайта связывания для FFA и около пяти дополнительных сайтов, которые могут быть заняты в физиологических условиях. Высвобождение FFA из жировой ткани снижается, когда заняты два высокоаффинных сайта, то есть при концентрациях FFA 0,9–1,2 мМ, в зависимости от вида (Scow and Chernick, 1970). У собак физические упражнения увеличивали молярное соотношение FFA: альбумин до более чем 2, а также увеличивали повторную этерификацию (Bülow, 1982), в то время как максимальное молярное соотношение FFA: альбумин, обнаруженное Bülow и Madsen (1981), составляло 7.
У собак физические упражнения увеличивали молярное соотношение FFA: альбумин до более чем 2, а также увеличивали повторную этерификацию (Bülow, 1982), в то время как максимальное молярное соотношение FFA: альбумин, обнаруженное Bülow и Madsen (1981), составляло 7.
Поставка альбумина в паховую жировую ткань собаки составляла около 10 нмоль 1 / мин на грамм (Bülow and Madsen, 1981), что, если бы все участки были незанятыми, поддерживало бы максимальную скорость высвобождения FFA, эквивалентную 70 нмоль / мин на грамм ткани ( см. Таблица 4.5 ). Однако гораздо более низкие скорости высвобождения FFA будут достаточными для насыщения двух высокоаффинных сайтов связывания. Точные нормы будут зависеть от доли занятых участков и, следовательно, от концентрации циркулирующих FFA.
Стимуляция симпатической иннервации способствует липолизу, но также вызывает сужение сосудов (см. Раздел 4.3), которого достаточно для задержки высвобождения FFA и, в меньшей степени, глицерина из ткани. Если сужение сосудов предотвращается с помощью антагонистов альфа-адренорецепторов, происходит немедленное высвобождение FFA и глицерина при нервной стимуляции (Fredholm, 1970). Кажется любопытным, что стимуляция симпатической иннервации должна увеличивать липолиз, но замедлять высвобождение FFA из жировой ткани.Это может отражать первоначальное предпочтение окисления глюкозы в начале тренировки или стресса с последующим переключением на окисление FFA. Это также может быть механизмом образования высокой локальной концентрации НА в тканях.
Если сужение сосудов предотвращается с помощью антагонистов альфа-адренорецепторов, происходит немедленное высвобождение FFA и глицерина при нервной стимуляции (Fredholm, 1970). Кажется любопытным, что стимуляция симпатической иннервации должна увеличивать липолиз, но замедлять высвобождение FFA из жировой ткани.Это может отражать первоначальное предпочтение окисления глюкозы в начале тренировки или стресса с последующим переключением на окисление FFA. Это также может быть механизмом образования высокой локальной концентрации НА в тканях.
Нарушение высвобождения FFA из жировой ткани из-за снижения кровотока также увеличивает повторную этерификацию (Kovach et al., 1976; Belfrage et al., 1979; Bülow and Madsen, 1981). FFA могут также накапливаться в ткани и высвобождаться при увеличении кровотока (Larsen et al., 1981). Дифференциальный захват и последующее высвобождение FFA и глицерина из жировой ткани во время и после стимуляции липолиза факторами, изменяющими кровоток, может составлять молярные отношения FFA: глицерин в плазме, превышающие 3, которые иногда наблюдаются.


